- A-
- A+
Mydrane

Folheto informativo: Informação para o doente
MYDRANE 0,2 mg/ml + 3,1 mg/ml + 10 mg/ml solução injetável
Tropicamida / cloridrato de fenilefrina / cloridrato de lidocaína
Leia com atenção todo este folheto antes de lhe ser administrado este medicamento, pois contém informação importante para si.
Conserve este folheto. Pode ter necessidade de o ler novamente.
Caso ainda tenha dúvidas, fale com o seu médico, farmacêutico ou enfermeiro.
Se tiver quaisquer efeitos secundários, incluindo possíveis efeitos secundários não indicados neste folheto, fale com o seu médico, farmacêutico ou enfermeiro. Ver secção 4.
O que contém este folheto:
1. O que é MYDRANE e para que é utilizado
2. O que precisa de saber antes de lhe ser administrado MYDRANE
3. Como é administrado MYDRANE
4. Efeitos secundários possíveis
5. Como conservar MYDRANE
6. Conteúdo da embalagem e outras informações
1. O que é MYDRANE e para que é utilizado
O que é MYDRANE
Este medicamento é uma solução, a qual lhe vai ser injetada no olho.
Contém 3 substâncias ativas:
• tropicamida que pertence a um grupo de medicamentos que bloqueia a passagem de impulsos por determinados nervos (conhecido como anticolinérgico),
• fenilefrina (sob a forma de cloridrato de fenilefrina) que pertence a um grupo de medicamentos que mimetiza os efeitos dos impulsos transmitidos por determinados nervos (o qual pertence aos simpaticomiméticos alfa),
• lidocaína (sob a forma de cloridrato de lidocaína) que pertence a uma classe de medicamentos denominada anestésicos locais do tipo amida.
Para que é utilizado
Este medicamento é utilizado apenas em adultos.
Ser-lhe-á administrado pelo seu cirurgião oftalmológico através de uma injeção no seu olho no início da cirurgia da catarata (enevoamento do cristalino), para dilatar a pupila do seu olho (midríase) e anestesiar o seu olho durante o procedimento cirúrgico.
2. O que precisa de saber antes de lhe ser administrado MYDRANE
Não lhe deve ser administrado MYDRANE:
• se tem alergia à tropicamida, ao cloridrato de fenilefrina e/ou ao cloridrato de lidocaína ou a qualquer outro componente deste medicamento (indicados na secção 6),
• se tem alergia aos anestésicos do tipo amida (articaína, bupivacaína, mepivacaína, prilocaína, ropivacaína),
• se tem alergia aos derivados da atropina.
Advertências e precauções
MYDRANE não é recomendado:
• na cirurgia da catarata quando combinada com um certo tipo de cirurgia ocular (vitrectomia),
• se a parte anterior (câmara anterior) do seu olho está inchada,
• se tem antecedentes de pressão ocular elevada aguda (glaucoma de angulo estreito agudo).
Deve falar com o seu médico especialmente se tiver:
• pressão arterial elevada (hipertensão),
• espessamento da parede arterial (aterosclerose),
• qualquer doença no coração e em particular se esta afetar o ritmo cardíaco,
• uma contraindicação para medicamentos que aumentem a pressão arterial (aminas vasopressoras: adrenalina, noradrenalina, dopamina, dobutamina) por via oral,
• hiperatividade da glândula tiroide (hipertiroidismo),
• perturbações na glândula da próstata,
• crises de epilepsia,
• qualquer doença no fígado ou problemas nos rins,
• qualquer problema com a sua respiração,
• perda da função muscular e fraqueza (miastenia gravis).
Outros medicamentos e MYDRANE
Informe o seu médico ou farmacêutico se estiver a tomar, tiver tomado recentemente ou se vier a tomar outros medicamentos.
Gravidez, amamentação e fertilidade
Este medicamento não deve ser utilizado:
• durante a gravidez,
• durante a amamentação.
Se está grávida ou a amamentar, se pensa estar grávida ou planeia engravidar, consulte o seu médico ou farmacêutico antes de tomar este medicamento.
Condução de veículos e utilização de máquinas
MYDRANE tem uma influência moderada na capacidade de conduzir e utilizar máquinas. Consequentemente, não deve conduzir e/ou utilizar máquinas até que a sua visão volte ao normal.
MYDRANE contém sódio
Este medicamento contém menos do que 1 mmol (23 mg) de sódio por unidade de dose, ou seja, é praticamente “isento de sódio”.
3. Como é administrado MYDRANE
Apenas lhe será administrado este medicamento caso já tenha demonstrado, numa avaliação pré-operatória, uma dilatação satisfatória da pupila com uma terapêutica midriática tópica.
Dose e modo de administração
• MYDRANE injetável ser-lhe-á administrado por um cirurgião oftalmológico, sob anestesia local, no início da cirurgia da catarata.
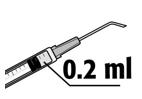
• A dose recomendada é de 0,2 ml de solução, numa injeção única. Não deverá ser administrada uma dose adicional, pois não foi demonstrado efeito adicional e além disso foi observado um aumento da perda de células endoteliais (células da camada que reveste a superfície posterior da córnea).
• É utilizada a mesma dose para adultos e idosos.
Se lhe for administrado mais, ou menos, MYDRANE do que deveria
O seu medicamento ser-lhe-á administrado por um cirurgião oftalmológico. É pouco provável que lhe seja administrada uma dose excessiva.
A sobredosagem pode causar um aumento na perda de células endoteliais (células da camada que cobre a superfície posterior da córnea).
Caso ainda tenha dúvidas sobre a utilização deste medicamento, fale com o seu médico ou farmacêutico ou enfermeiro.
4. Efeitos secundários possíveis
Como todos os medicamentos, este medicamento pode causar efeitos secundários, embora estes não se manifestem em todas as pessoas.
Complicações mais graves e bem conhecidas que ocorrem durante ou após a cirurgia da catarata:
Pouco frequentes: podem afetar até 1 em 100 pessoas
• Lesão do cristalino (rutura da cápsula posterior),
• Inchaço da retina (edema macular cistoide).
Nesta situação procure aconselhamento médico urgente.
Outros efeitos secundários:
Pouco frequentes: podem afetar até 1 em 100 pessoas
• Dores de cabeça,
• Inchaço da córnea (queratite), pressão no olho aumentada, vermelhidão do olho (hiperemia ocular),
• Pressão arterial elevada (hipertensão).
Comunicação de efeitos secundários
Se tiver quaisquer efeitos secundários, incluindo possíveis efeitos secundários não indicados neste folheto, fale com o seu médico, farmacêutico ou enfermeiro. Também poderá comunicar efeitos secundários diretamente ao INFARMED, I.P. através dos contactos abaixo. Ao comunicar efeitos secundários, estará a ajudar a fornecer mais informações sobre a segurança deste medicamento.
INFARMED, I.P.
Direção de Gestão do Risco de Medicamentos
Parque da Saúde de Lisboa, Av. Brasil 53
1749-004 Lisboa
Tel: +351 21 798 73 73
Linha do Medicamento: 800222444 (gratuita)
Sítio da internet: http://www.infarmed.pt/web/infarmed/submissaoram
E-mail: farmacovigilancia@infarmed.pt
5. Como conservar MYDRANE
Manter este medicamento fora da vista e do alcance das crianças.
Não utilize este medicamento após o prazo de validade impresso na cartonagem, blister e ampola. O prazo de validade corresponde ao último dia do mês indicado.
O medicamento não necessita de quaisquer precauções especiais de conservação.
Apenas para uma utilização única. Este medicamento deve ser utilizado imediatamente após a primeira abertura da ampola.
Não deite fora quaisquer medicamentos na canalização ou no lixo doméstico. Pergunte ao seu farmacêutico como deitar fora os medicamentos que já não utiliza. Estas medidas ajudarão a proteger o ambiente.
6. Conteúdo da embalagem e outras informações
Qual a composição de MYDRANE
• As substâncias ativas são: tropicamida 0,04 mg, cloridrato de fenilefrina 0,62 mg e cloridrato de lidocaína 2 mg por cada dose de 0,2 ml, o que corresponde a 0,2 mg de tropicamida, 3,1 mg de cloridrato de fenilefrina e 10 mg de cloridrato de lidocaína por cada 1 ml.
• Os outros componentes são: cloreto de sódio, fosfato disódico dodeca-hidratado, fosfato disódico di-hidratado, edetato dissódico, água para preparações injetáveis.
Qual o aspeto de MYDRANE e conteúdo da embalagem
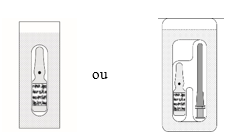
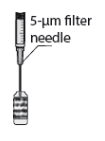
MYDRANE é uma solução injetável límpida, ligeiramente amarela-acastanhada, praticamente isenta de partículas visíveis, acondicionada numa ampola de vidro castanho de 1 ml. Cada ampola estéril contém 0,6 ml de solução injetável e encontra-se acondicionada separadamente ou em conjunto com uma agulha estéril com filtro de 5 micrómetros num blister selado papel/PVC.
Cada embalagem contém 1 ou 20 ou 100 ampolas estéreis com agulha(s) estéril(eis) com filtro de 5 micrómetros fornecidas separadamente ou em conjunto no mesmo blister. As agulhas com filtro de 5 micrómetros devem ser utilizadas apenas para retirar o conteúdo da ampola. Todos os componentes são apenas para uma única utilização.
É possível que não sejam comercializadas todas as apresentações.
Titular da Autorização de Introdução no Mercado e Fabricante
Titular da Autorização de Introdução no Mercado
Laboratoires THEA
12, Rue Louis Blériot
63017 Clermont-Ferrand Cedex 2
França
Fabricante
Delpharm Tours
Rue Paul Langevin
37170 Chambray les tours
França
ou
Laboratoires Thea
12, Rue Louis Blériot
63017 Clermont-Ferrand Cedex 2
França
Este medicamento encontra-se autorizado nos seguintes Estados membros do Espaço Económico Europeu (EEE) sob as seguintes denominações:
Alemanha, Áustria, Bélgica, Bulgária, Chipre, Croácia, Dinamarca, Eslováquia, Eslovénia, Finlândia, França, Grécia, Holanda, Itália, Irlanda, Luxemburgo, Polónia, Portugal, Roménia, Reino Unido, República Checa, Suécia Mydrane
Espanha, Irlanda Fydrane
Noruega Mydane
Este folheto foi revisto pela última vez em 06/2019
A informação que se segue destina-se apenas aos profissionais de saúde:
Incompatibilidades
Não foram reportadas na literatura nem durante os ensaios clínicos, incompatibilidades entre os produtos mais frequentemente utilizados na cirurgia da catarata e as substâncias ativas. Para os viscoelásticos comuns, tal foi também confirmado pelos de testes de interação farmacêutica.
Advertência
Não utilizar se o blister estiver danificado ou rasgado. Abrir apenas sob condições asséticas. Garante-se que o conteúdo do blister se encontra estéril.
Como preparar e administrar MYDRANE
Solução para utilização apenas num olho por via intracameral.
MYDRANE deve ser administrado por injeção intraocular na câmara anterior do olho (injeção intracameral), por um cirurgião oftalmológico, nas condições de assepsia recomendadas para a cirurgia da catarata.
Antes da injeção intracameral, a solução deve ser visualmente inspecionada e só deverá ser utilizada se estiver límpida ligeiramente amarela-acastanhada e praticamente isenta de partículas visíveis.
A dose recomendada é de 0,2 ml de MYDRANE; não deverá ser administrada uma dose adicional, pois não foi demonstrado efeito adicional e foi observado um aumento da perda de células endoteliais.
O produto deve ser utilizado imediatamente após a primeira abertura da ampola e não deve ser reutilizado em outro olho ou em qualquer outro doente.
Apenas para a apresentação em kit (i.e. blister contendo uma ampola e uma agulha): cole a etiqueta do blister no processo do doente.
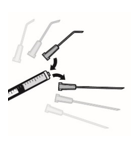
Siga as seguintes instruções para preparar MYDRANE para a injeção intracameral:
1. Verifique o blister antes de o abrir para garantir que está intacto. Retire a película do blister em condições asséticas para garantir a esterilidade do conteúdo.
2. Abra a ampola estéril que contém o produto. A ampola deve ser aberta pelo ponto de quebra (OPC) da seguinte forma: segure a parte de baixo da ampola com o polegar a apontar para o ponto colorido. Segure o topo da ampola com a outra mão, posicionando o polegar no ponto colorido e pressione para trás de forma a quebrar no ponto de quebra que está abaixo do ponto colorido.
3. Encaixe a agulha estéril com filtro de 5 microns (fornecida) numa seringa estéril. Retire a proteção da agulha estéril com filtro de 5 microns e aspire, pelo menos, 0,2 ml de solução injetável da ampola para a seringa.
4. Retire a agulha da seringa e adapte na seringa uma cânula apropriada para a câmara anterior.
5. Cuidadosamente deve expelir o ar da seringa. Ajuste até aos 0,2 ml. A seringa encontra-se pronta para ser utilizada.
6. Injete lentamente os 0,2 ml contidos na seringa na câmara anterior do olho, numa injeção única, através da paracentese ou da incisão principal.
Após a utilização, rejeite a solução que ainda reste. Não a guarde para uma utilização subsequente.
Qualquer medicamento não utilizado ou resíduos devem ser eliminados de acordo com as exigências locais. Elimine as agulhas utilizadas nos contentores adequados.